《多肽鏈》原創出品
作者|穆白
楔子
“疫情暴發無法避免,大流行卻可以防范(Outbreaks are Inevitable, But Pandemics are Optional)。”
著名流行病學家拉里·布里連特(Larry Brilliant)的這一金句,對于經歷了新冠疫情兩年多的我們,有何啟示?
兩年間,這場席卷全球的世紀大流行奪去了超過600萬人的生命。如果沒有疫苗,這個死亡數字又將會是多少?
回溯一下過去時間并不長的諸多信息,有多少國家的國民因匱乏疫苗而陷入面對新冠肺炎的恐慌之中?而身在中國的我們,因何能從容有序地完成近34億劑新冠疫苗的接種?
對于未來,我們要如何“不必生活在對另一次大流行的恐慌中”?
當2020年疫情爆發之后,中國疫苗企業“五路”齊發時,恐怕沒有多少人篤信中國疫苗不僅進入全球成功研發新冠疫苗的第一梯隊,在滿足國內需求的同時源源不斷將產品輸出到海外。
向來在國際疫苗市場上的“無名之輩”,卻成為新冠肺炎狙擊戰的“排頭兵”,中國科興、國藥集團、康希諾的新冠疫苗相繼被列入世衛組織緊急使用清單(EUL),與國際疫苗制造大廠并肩消除免疫鴻溝。
這是中國疫苗崛起的一大步。
壹| 接軌
“死磕”世衛標準的意義
近日,一條關于科興的脊髓灰質炎滅活疫苗(sIPV)通過世界衛生組織預認證(Prequalification, 以下簡稱“PQ”)的消息不脛而走。
盡管自1988年以來,全球范圍通過大規模疫苗接種,脊髓灰質炎野病毒已在大多數國家和地區停止了傳播,但巴基斯坦、阿富汗目前仍有脊灰野病毒I型流行,中國因與這些疫情國家接鄰,部分地區面臨較高輸入風險。
值得關注的是,新冠大流行直接導致了脊灰病例的增加。2021年全球各種形式的脊灰病例達1226例,這個數字遠超2018年的138例。消滅脊灰“最后一公里”,仍然挑戰重重。
在此背景下,從2015年啟動臨床研究伊始,就使用國際化標準的中國科興Sabin株脊灰疫苗,獲得世界衛生組織PQ認證顯得尤為“應景”。
脊灰疫苗是科興去年7月在國內剛獲得國家藥監局注冊批件的新疫苗。也是科興繼甲型肝炎滅活疫苗孩爾來福(成人、兒童)之后,第三款獲得PQ認證的疫苗產品。
至今,科興孩爾來福已上市20年,是國內使用量最大的甲肝滅活疫苗,也是全球第二、中國第一個通過世衛組織PQ認證的甲肝滅活疫苗。
恰是因為通過了世衛組織的PQ認證,孩爾來福才得以進入泛美衛生組織(PAHO)和聯合國兒童基金會(UNICEF)的采購清單,向全世界供貨超三年。
截止2021年末,孩爾來福已在全球20余國家和地區安全接種超過1億劑次,另在20個國家提交了產品注冊申請。
然而,通過世衛組織預認證并不是一件容易的事。
取得世衛組織PQ認證,不僅意味著該疫苗產品安全性、有效性與生產質量的保證,還可以被聯合國兒童基金會,抗擊艾滋病、結核病和瘧疾全球基金,艾滋病規劃署,世界銀行,亞洲開發銀行等國際組織機構,以及一些國家政府部門等大宗采購。
對于疫苗企業而言,申請世衛組織PQ認證是對自身研發、臨床、生產、質控以及銷售環節的一次系統性檢查和優化。
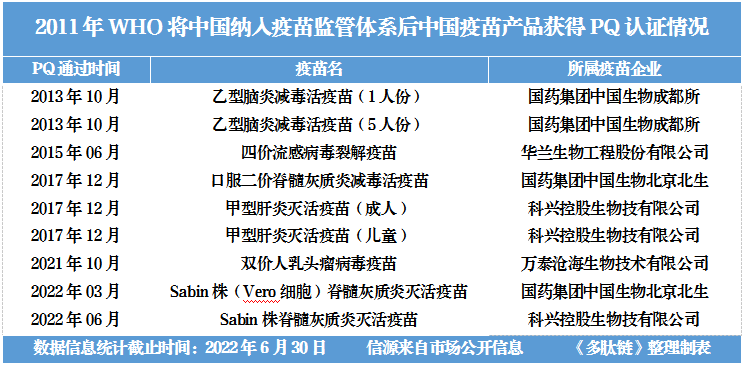
2011年3月,世衛組織宣布中國國家藥品監管機構通過了WHO疫苗監管體系的評估,國內疫苗企業具備了申請PQ認證的資格。但之后的11年,僅有包括科興3款疫苗在內的9個中國疫苗通過了PQ認證。
除科興外,也只有國藥集團、華蘭生物、萬泰生物三家中國疫苗公司,獲得了進入國際市場最重要的“入場券”。
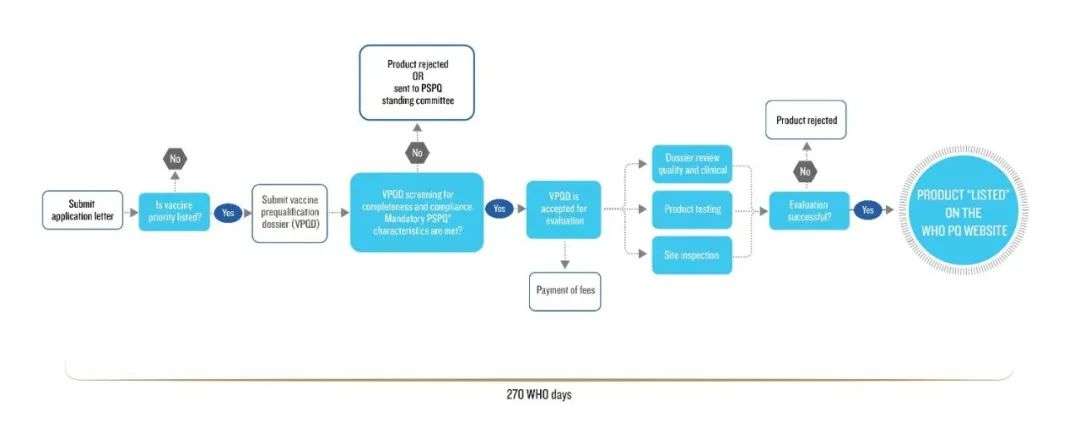
PQ認證的整個流程并不算多復雜(如下圖),但每一個細節世衛組織都有著嚴苛的要求。?
比如,世衛組織非常強調疫苗生產商必須按其標準和要求,提供詳細的研發生產資料和臨床研究試驗資料,而且必須包含關鍵性技術資料。
由于國內很多疫苗廠商在做研發設計起時沒有按照世衛組織要求的方式進行記錄和整理,后續生產、質量等環節也就無從談起。
因此,申報資料環節就已經是個大問題了。
申報資料審核通過,世衛組織才決定是否進行現場檢查。PQ認證實際上分為完全評審和簡略評審,前者需要進行現場審查,而后者則是針對SRA(指WHO認可的嚴格藥監部門批準的藥品)。
由于目前中國并未在SRA清單上,國內參評的所有藥劑都必須進行現場審核,所以我國包括疫苗在內的藥劑產品通過PQ認證整個流程的程序多,時間跨度也更長。
以中國第一個通過PQ認證(2013年10月)的國藥乙腦疫苗為例,整個認證流程前后歷經9年,耗費4000萬美元做技術支持,才得以最終接軌這條國際標準線。
2021年10月,備受矚目的萬泰生物雙價人乳頭瘤病毒疫苗(HPV)獲得PQ認證,但實際上早在2014年9月萬泰生物就啟動了PQ認證計劃。
相比較而言,科興的3款疫苗產品取得PQ認證已經算是很順利的:甲肝滅活疫苗2014年10月啟動認證,2017年12月通過認證;其脊灰滅活疫苗是2020年初啟動,歷時2年就撞線了PQ認證。
盡管數量稀少,但這9個疫苗產品都是中國疫苗出海的堅實跬步。
貳| 出海
“由內而外”的必然
創新與出海,毫無疑問是中國醫藥產業未來發展的兩大主旋律。
無論是創新藥的蓬勃興起,還是產品和技術的輸出海外,都必須建立在一個最重要的前提基礎上,那就是接軌國際準則。
這也是我們討論世衛組織PQ認證重要性的意義所在。
然而,一個無法忽略的現實是:如果從通過PQ認證的數量比較來看,中國醫藥企業不僅遠遠落后于美歐發達國家,連印度藥企都可以碾壓我們。
或許很多人并不知道,全球超過30%的疫苗(新冠前數據)是由印度提供,雖然缺乏核心專利技術,但印度是世界上最大的疫苗生產國和出口國。
全球最大疫苗制造商——印度血清研究所,每年生產15億劑疫苗,為全球165個國家提供20種疫苗產品。
按照世衛組織公布的數據:目前全球通過PQ認證的制劑共有593個品種,印度企業產品占比高達65%,中國僅為8%;在通過PQ認證的257個品種中,印度占比43%,我們還不到4%。
“內向型”的發展,自然就缺乏對國際規則的接駁。
從獲取國際資質的動機來講,由于國情與發展環境的不同,國內藥品監督管理體系與標準與國際審評體系有很多差異之處。
如果“內外兼修”的話,對于藥企而言是很大的發展負擔。
國藥集團乙腦疫苗花費9年4000萬美金的代價,是大部分國內疫苗企業無法承受之重。但總要有一些“孤勇者”去開創新市場。
科興在2012年自荷蘭Intravacc公司獲得sIPV技術轉移資格時,就已經將目光投向了未來的全球市場;萬泰生物的HPV疫苗也早在研發之初,就設定了與國際疫苗巨頭掰腕的情節設定。
在啟動世衛組織PQ認證時,這兩家企業都還處在“捉襟見肘”的投入時期,不僅要付出千萬美金的代價,能否取得認證還是未知數。
不過,中國醫藥企業出海早晚是要邁出這一步的。隨著國內醫藥市場環境變化,行業競爭加劇,企業自主研發能力不斷增強,一波出海潮早已按捺不住。
而政策面也為疫苗企業出海鋪就了最好的港灣。
2019年6月29日,全國人民代表大會通過了“疫苗管理法”,其中明確規定:國家鼓勵疫苗生產企業按照國際采購要求生產、出口疫苗。
參與起草疫苗法的一位專家曾向媒體直言,鼓勵疫苗企業出口,要提升世衛組織預認證重要性的認識,甚至在一定情況下可以作為“替代性政策工具”。
可以預見的是,一旦調動起中國疫苗企業出海的積極性,更多中國疫苗取得世衛組織PQ認證就只是時間的問題了。
叁| 輸出
全球治理的中國能量
2021年,白宮公布了一項計劃:如果撥付資源,下一次流行的疫苗將在100天內研發。
毫無疑問,新冠疫情也催化了全球主要國家在疫苗研發領域的一次技術升級。在此之前,一個共識性的判斷是從疫苗研發到投入使用至少需要5年的時間,但新冠疫苗的交付時間卻縮短到了12個月。
讓幾乎所有人出乎預料的是,全球最先進入III期臨床試驗的9種疫苗,竟然有5款是由中國企業原創研發。無論是原創技術還是研發速度,都刷新了全世界對于中國疫苗的認知。
以科興的數據為例,截止目前科興向全球60多個國家和地區供應超過28億劑(約有50%輸出到海外市場)新冠疫苗,占比全球市場的23%左右。
被世衛組織列入緊急使用清單,大規模輸出海外,在新冠疫苗上中國疫苗企業可謂一戰成名。這必將大為改觀世衛等國際組織對中國疫苗的態度,從而進一步加速中國疫苗的出海步伐。
一戰成名卻也并非一蹴而就,中國疫苗只是在經歷了漫長積淀,厚積薄發在這個特殊的時間窗上。
如果我們要大概切分中國疫苗的發展歷程,基本可以劃定三個階段,簡單一點表述就是:
2011年之前走過的三四十年跨度,從疫苗進口到自給再到自主的1.0時代。
上世紀70年代,涌現的一批以陶其敏為代表的中國科學家,在一窮二白的環境中研制出堪比“雜交水稻”“神州飛船”的第一代血源性乙肝疫苗。
自此之后,中國疫苗長坡厚雪,麻疹疫苗、脊灰疫苗、腦膜炎疫苗、甲肝疫苗直至如今的新冠疫苗,這些自行研發的疫苗都為我們的疫苗自信奠定了堅實的技術底氣。
2011年之后的近十年開始融入國際體系,實現疫苗產品輸出的2.0時代。
盡管被世衛組織納入疫苗監管體系不過是11年前的事,但無論是國藥集團這樣的“大國重器”,抑或是20余年疫苗行業錘煉出來的科興,還是海歸創業產業報國的行業新銳康希諾,都擁有放眼全球市場,比肩巨頭的雄心壯志。
這個階段,我們也遭遇過長春長生式的“疫苗信仰”倒退,疫苗全行業陷入難言窘境,但敗案終究抵不住主流的車轍。走出去,揚帆逐浪,用優質產品換得國際市場對中國疫苗成長的尊重與認可。
而以新冠疫情再劃分界線,中國疫苗進入嶄新3.0時代。中國疫苗企業集體加速出海,將產業鏈縱深向全球。
?圖片來源:鳳凰衛視?
2022年4月,中國科興援建埃及疫苗冷庫項目在開羅開工,建成后不僅將成為非洲最大的疫苗倉儲中心,也將大幅提升整個非洲的疫苗供應能力;5月中,投資1億美元的智利科興疫苗工廠開工,建成后年產能將達5000萬劑,助力智利實現疫苗本地產業化生產。
而就在近期,金磚國家領導人第十四次會晤系列活動正在向全球傳遞“金磚力量”,其中金磚國家疫苗研發中心是五國合作的重要一環。
受科技部委托,科興于2021年5月正式成立金磚國家疫苗研發中國中心,過去兩年多時間里,科興與巴西、南非的合作方完成了疫苗臨床研究、本地化生產等多方面合作。
產業鏈的全球化縱深布局,帶動的是包括政府、學界、企業、資本構成的疫苗產業大生態的建立。
汲取印度疫苗大卻不強的根本原因,當中國疫苗接軌國際標準,參與全球公共衛生治理時,自主自研的核心技術才是我們能夠實現產業鏈縱深的關鍵動能。
盡管當前葛蘭素史克、賽諾菲、默沙東、輝瑞四大巨頭仍占據全球疫苗市場90%的營收,印度血清研究、賽諾菲、葛蘭素史克、BBIL和Haffkine五家企業仍擁有全球60%的疫苗產量,但在可以預見的未來,這個格局必然會被改寫。
因為,中國疫苗企業梯隊的崛起,毋庸置疑。